1953년 4월 25일 네이처지에 20세기 생명과학계의 최대 사건인 DNA 이중나선의 구조가 발견 된 이후 이미 2000년대 초 인간 게놈분석을 통하여 30억쌍의 인간 염기 서열이 모두 밝혀졌다. 그리고 2012년 유전자 가위를 통하여 DNA의 특정 부위를 자르고 편집(제거, 치환) 할 수 있는 가능성이 열리면서 전세계 생명공학관련 산업계/학계는 기술 선점을 위한 초경쟁을 벌이고 있다. 뉴스톱은 유전자 가위와 관련된 기술현황과 특허전쟁을 살펴본다. 그리고 최근 이 분야에서 선도적인 위치를 점유하고 있지만 국가지원을 받아 개발한 유전자 가위 관련 특허기술을 본인이 대주주로 있는 회사로 팔아넘긴 ‘특허 날치기’ 시비에 휘말린 김진수 기초과학연구원(IBS) 유전체교정연구단장의 사례를 통하여 직무발명관련 문제점과 연구윤리를 짚어보고자 한다.
1. 엉뚱한 곳에서 시작된 크리스퍼 유전자 가위 기술
2012년 이후 한 해 수백편이 넘는 논문이 발표되고 있는, 생명공학 분야 최대의 격전장이라고 표현되고 있는 유전자 가위의 위대한 여정의 시작(1980년대 후반)은 미국의 생물학자 에릭 랜더가 생물학 유명 저널인 '셀'에 기고한 'The heroes of CRISPR'을 통해 더듬어 보면. 시작은 늘 그렇듯 고난과 우연의 연속이었다.
1980년대 후반 스페인 동부의 작은 대학에서 박사과정을 밟던 프란시스코 모지카(Francisco Mojica)는 염분에 잘 견디는 해안가 박테리아 유전체 분석 연구를 하고 있었다. 우연히 해안가 박테리아 DNA 염기서열에서 독특하게 반복되는 구조를 처음 발견하였다. 비슷한 시기에 일본 오사카대 소우 이시노 박사팀 역시 대장균의 유전체를 분석하다 특이한 유전자 염기서열 패턴을 발견한다. 그런 구조가 다른 박테리아 종에서도 존재함이 알려지지만 어떤 기능이나 역할을 하는지 몰라 CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)란 이름을 붙인다. 크리스퍼는 "규칙적으로 반복되는 짧은 염기 서열 덩어리"라는 뜻이다. 쉽게 설명하면 아직은 잘 모르는 염기서열 덩어리란 뜻이다.
프란시스코 모지카는 추가 연구를 통하여 크리스퍼의 염기서열이 박테리아를 공격하는 바이러스의 염기서열과 일치함을 발견하여 해당 구조가 면역체계와 관련이 있음을 예측하는 논문을 2003년 11월 네이처에 보냈지만 거절되고 다른 생물학 저널에 실리면서 세상에 알려지게 된다. 해당 논문은 사실 유전자 가위에 대한 논문은 아니다. 그러나 이것을 시발점으로 하여 세포의 유전자 레벨 면역 기제와 유전자 가위 관련 기술의 가능성이 태동한 것이기 때문에 학계에서는 프란시스코 모지카(Francisco Mojica)를 가장 강력한 노벨 생리의학상 후보중의 한 명으로 보고 있다.

비슷한 시기에 프랑스의 국방부 산하 기관에서 탄저균을 정밀식별하는 기술을 개발 중인 질 베르나우드(Gilles Vergnaud) 역시 프란시스코 모지카와 유사한 결론을 얻었지만 역시 4수 끝에 2005년 4월 관련 저널에 논문을 공개할 수 있었다. 당시 해당 연구들은 유명 저널에 실릴 정도의 '섹시한' 주제가 아닌 것으로 인식되었다. 그도 그럴 것이 특정 염기서열의 반복 페턴이 세포의 면역체계와 관련 있고 이것을 응용하면 유전자를 정밀하게 편집할 수 있는 유전자 가위로 쓰일 수 있다는 사실을 당시에는 상상할 수 없었기 때문이다.
초기 연구에서 또 한 명의 공헌자는 요구르트 젖산균을 연구하던 프랑스의 미생물학자인 필립 호바스(Philippe Horvath) 이다. 그는 박테리아 유전자에서 발견되는 독특한 염기서열 패턴이 바이러스의 공격에 대응하는 면역체계 기능을 한다는 것을 실험으로 입증했다. 이 과정에서 침입자 바이러스의 유전자를 잘라 기능을 못하게 하는 일종의 제한 효소(절단 효소)인 캐스9(Cas9)의 정체를 처음 규명하게 된다. 그래서 후에 크리스퍼 유전자 가위의 영문 명칭이 CRISPR/Cas9으로 불려지게 되었다.
결국 생물학 박사과정 학생의 학문적인 호기심과 프랑스 국방부의 군사생물방어연구 그리고 야쿠르트 제조시 발효품질 향상을 위한 연구에서 면역반응체계의 유전자 스케일 규명과 이를 응용한 유전자 가위 개발이 시작된다.
2. 유전자 잘라 붙이기 기술의 진화
병을 일으키는 유전자를 제거(Knock-Out)하거나 병든 유전자를 건강한 유전자로 치환(Knock-In)하기 위해서는 유전자의 특정 염기서열이 어떤 기능을 하는지 알아야 하고 해당 염기서열만을 정확하게 찾아내서 분리하는(잘라내는) 유전자 가위 기술이 필요하다.
세포의 면역 반응체계에서 응용한 3세대 CRISPR/Cas9 유전자 가위의 개념을 처음 창안하고 인공적으로 만들어 낸 시기는 2012년 8월 17일이다. 미국 UC버클리 제니퍼 다우드나(Jennifer A. Doudna) 교수와 스웨덴 우메아대 (Umea University) 엠마뉴엘 카펜디어/샤르팡티에(Emmanuelle Charpentier) 교수가 이끄는 공동연구팀이 사이언스지에 발표한 논문(A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity)이 시발점이 되었다. 하이라이트는 원하는 특정 염기서열을 찾아 절단 할 수 있도록 프로그래밍(설계)이 RNA 수준에서 가능함을 제시한 것에 있다.

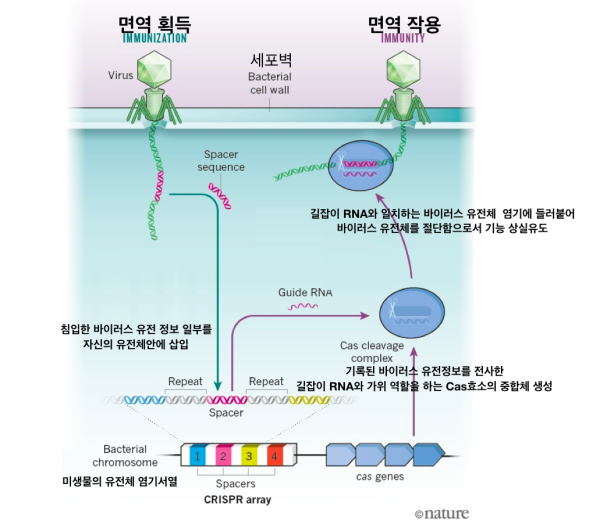
프로그래밍(설계)이 RNA 수준에서 가능하다는 것은 위 그래픽에서 보여주듯이 자르고자 하는 유전체 표적 염기서열에 들러붙을 수 있도록 길잡이 RNA(gRNA)의 염기배열과 실제 유전체를 자르는 Cas9효소의 중합체를 인위적으로 만들 수 있다는 뜻이다. 이전 세대 유전자 가위에 비하여 비용효과적이고 정확성이 높아 산업화가 가능하게 되면서 현재의 유전자 가위 열풍을 만들어 냈다.
[제니퍼 다우드나 교수의 크리스퍼 유전자 가위 강연]
UC 버클리 제니퍼 다우드나 교수팀이 시험관 수준에서 원핵세포를 대상으로 실험하였다면 MIT와 하버드대 공동연구소인 브로드연구소(The Broad Institute)의 펭 장(Feng Zhang) 교수가 이끄는 공동연구팀은 진핵세포(쥐와 인간)를 대상으로 더욱 간편하게 (제니퍼 다우드나 교수팀이 사용했던 crRNA:tracrRNA 이 둘을 합친 키메라 RNA 와 Cas9을 디자인) 유전체를 잘라 교정하는 데 성공했다고 2013년 2월 15일에 사이언스에 논문을 발표했는데 이들은 동시에 여러 표적 유전체를 교정하는 기술까지 개발하면서 상용화 기술을 한단계 높였다는 평가를 받고 있다. 브로드연구소는 3.5세대 유전자 가위라고 알려진, 정확도와 간편성을 더욱 높인 CRISPR/Cpf1 유전자 가위를 2015년 발표하고 인간 유전체(게놈)을 편집할 수 있음을 실험으로 보이면서 한 발 앞서 나가기 시작한다.

3. 한국의 유전자 가위 기술과 스타과학자 김진수의 탄생

2018년 8월 네이처 바이오테크놀로지에 3.5세대 유전자 가위인 CRISPR/Cpf1 을 활용한 4편의 연구성과 논문이 실렸는데 그중 3편이 한국 연구팀의 논문이었다.(네이처 바이오테크놀로지 커버 디자인은 이러한 연구성과를 다트로 표현 한 것이다.)
기초과학연구원(IBS) 유전체교정연구단 김진수 단장의 연구팀 논문이 2편이고 서울아산병원 아산생명과학연구원 및 울산의대의 연구팀의 논문이 1편이었다.
특히 김진수 교수 연구팀은 김 교수가 설립한 바이오기업 툴젠과의 공동연구를 통하여 CRISPR/Cpf1이 3세대 유전자 가위인 CRISPR/Cas9에 비하여 정확도가 월등이 높다는 것을 실험으로 증명하고 해당 기술을 통하여 생쥐의 유전자를 교정해서 돌연변이 쥐를 만들어 내는데 성공했다. CRISPR/Cpf1은 브로드 연구소 Feng Zhang 교수팀이 만들었지만 DNA의 특정부위를 정확히 잘라내는 작동 원리와 검증방법을 김진수연구팀이 밝혀냈다. 인간 유전체 적용 가능성을 더욱 높인 것으로 평가 받는다.
유전자 가위 기술엔 'Off-Target Effect'로 불리는 일종의 부작용이 있다. 유전자 가위가 원하는 DNA 염기서열뿐 아니라 이와 유사한 염기서열을 지닌 위치에 작동함으로써 예상했던 곳과 전혀 다른 위치에 유전자 변이를 유발하기도 하는데 이를 제어하고 정확성을 측정할 수 있는 객관적인 기술을 최초고 고안한 것이다.

김진수 교수는 이에 앞서 2013년 1월 이미 네이처 바이오테크놀로지에 서울대 소속이면서 한국연구재단의 ‘창의연구지원사업’ 일환으로 연구비를 받아 논문을 발표했다. 2012년 8월 제니퍼 다우드나 교수팀이 최초로 CRISPR/Cas9 유전자 가위를 시험관내 수준에서 (In Vitro) 원핵세포에 적용하였고 2013년 2월 브로드 연구소 펭 장 교수팀이 진핵세포(쥐와 인간)에 적용했다면 김진수 교수팀은 이를 인간세포에 적용하고 그 기작을 밝혀 낸것이다.
논문 발표 순서로 보면 인간 세포에 적용한 것은 펭 장 교수팀이 근소하게 빠르지만 미국 특허청 가출원일로 보면 김진수 교수팀의 유전자 가위(ChimercRNA(sgRNA):Cas9) 최초 출원일은 2012년 10월, 펭 장 교수팀의 유전자 가위(CRISPR-Cas)는 2012년 12월로 김진수 교수팀이 근소하게 빠르다. 이러한 업적으로 기초과학연구원(IBS) 유전체교정연구단장 임명(2014년), 아산의학상 수상(2017년), 동아시아 스타과학자로 RNA연구단장인 김빛내리 교수와 함께 선정되는 영예를 얻게 된다. 적어도 크리스퍼 유전자 가위 합성과 관련 응용과학분야에 있어서 김진수 교수는 가장 앞서가는 연구자로 봐도 무방하다는 것이 학계 입장이다.
4. 전 세계적 유전자 가위 기술 '특허 전쟁'
삼성과 애플의 특허전쟁 만큼이나 많은 관심을 모았던 유전자 가위 특허전쟁 역시 생명공학 분야에서 가장 뜨거운 논쟁거리다. 대부분의 전문가들은 이제 시작이라고 보는 견해다.
특히 유전자 가위는 인위적으로 합성과 프로그램이 가능하기 때문에 같은 역할을 하는 다양한 유전자 가위 발명이 가능하고 각 유전자 가위마다 효율과 정확성 제조원가 등이 천차만별일 수 있어 다양한 특허 출원이 가능하다. 특허마다 청구항이 많게는 155개에 이르기도 한다.(UC버클리가 출원한 최초의 CRISPR/Cas9 관련 특허 출원서는 페이지만 219p에 달한다.) 또한 생명공학과 바이오산업분야에서 다양하게 응용가능한 기술이라 많은 연구기관, 학계 그리고 산업계의 수많은 특허 출원이 이루어지고 있고 그만큼 첨예한 특허분쟁이 촉발되고 있다.
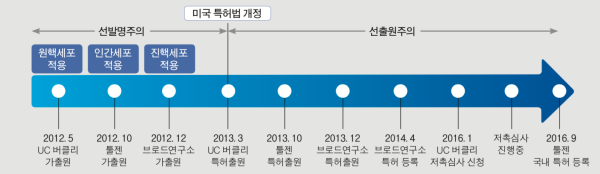
2013년 미국 특허법도 선발명주의에서 선출원주의로 변경되던 시기라서 그 이전과 이후의 특허 출원심사에 차이가 있었다. 2013년 이전에는 먼저 발병했음을 증명하느냐가 중요했지만 그 이후에는 먼저 출원했느냐가 중요해졌다. 특허출원 관리 방식이 급변하던 시기다.
특허분쟁에 있어서 다른 중요한 부분이 신규성 상실과 관련된 부분이다. 미국 특허는 신규성(novelty) 및 비자명성(non-obviousness)을 충족하여야 하는데, 미국 내외에서의 선행 특허, 미국 내외에서의 논문 등을 포함한 간행물 발표 등이 출원자보다 먼저 타인에 의하여 실시된 것이 확인될 경우 해당 특허는 신규성 상실에 해당하여 특허로 등록되기 어렵다. 시기적으로도 2012년 UC 버클리 제니퍼 다우드나 교수팀의 최초 논문 발표와 특허 출원 이후에 근소한 차이를 보이며 브로드 연구소 펭 장 교수팀과 한국 김진수 교수팀이 논문발표와 특허 출원에 있어서 경합을 벌이고 있음을 알 수 있다.
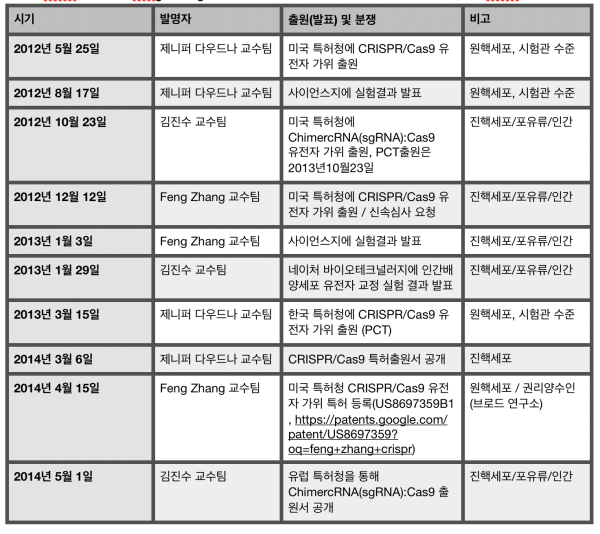
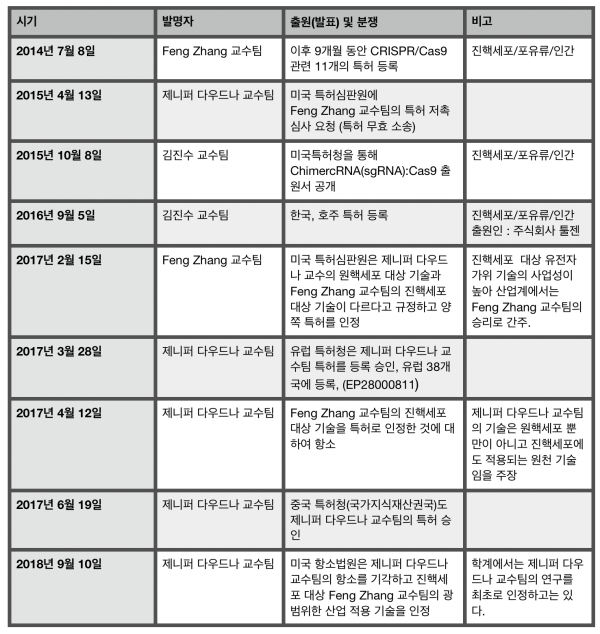
제니퍼 다우드나 교수팀은 가장 먼저 특허를 출원했으나 결국 펭 장 교수팀 특허가 인정되었다. 출원은 조금 늦더라도 세포 실험까지 입증한 선발명을 미국 특허청이 중시했기 때문으로 분석된다. 김진수 교수팀 미국 특허출원은 2012년 10월로서 세포 실험까지 입증한 출원으로는 가장 빨랐다. 펭 장 교수팀과 법적인 다툼을 해볼만 했지만 막대한 소송비용 문제로 포기한 것으로 알려졌다.
5. 유전자 가위 기술 산업계 현황
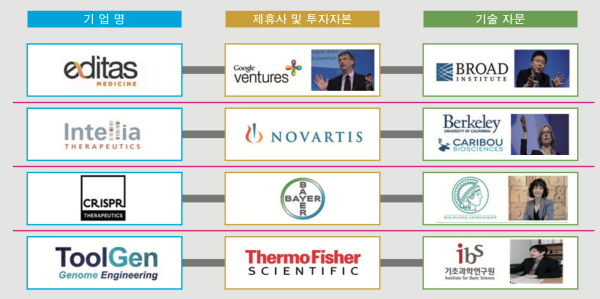
유전자 가위 관련 선도 과학자인 제니퍼 다우드나 교수, 엠마뉴엘 카펜디어 교수 그리고 펭 장 교수 모두 막강한 투자자들의 도움을 받고 있으며 유명 회사 파운더나 기술 자문으로 활동하고 있다. 한국에서도 김진수 교수가 1999년 세운 툴젠이 대표적인 기업인데 비교적 오래전 부터 유전체 정보 활용을 위한 핵심 도구 개발에 집중해 오고 있다고 밝히고 있다.
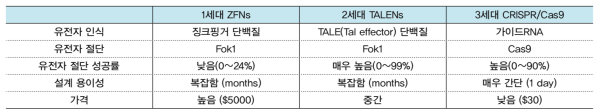
세포 내에서 유전정보를 바꾸는 유전자 교정의 핵심이 되는 유전자 가위 기술 분야에서 1세대 유전자가위(ZFN), 2세대 유전자가위(TAL effector nuclease ; TALEN)를 이어 3세대 유전자가위(CRISPR/Cas9) 기술까지 모두 독자적으로 개발한 오랜 업력을 가지고 있다고 한다. 그러나 위의 도표에서 처럼 제휴사 및 투자 자본과 기술자문 지원 그룹의 규모와 수준은 선진국 수준에 한 참 뒤떨어져 있다. 제니퍼 다우드나 교수와 엠마뉴엘 카펜디어 교수가 설립한 크리스퍼 쎄라퓨틱스는 이미 나스닥에 상장에 있으며 바이엘, 노바티스 같은 다국적 제약기업의 집중적인 투자를 받고 있는 것을 보면 이미 기울어진 운동장에서의 경쟁이라고 봐도 무방한 것이 우리의 현실이다.
6. 김진수 교수 '특허 날치기'인가 '정당한 절차'인가
공교롭게도 김진수 교수와 유전자 가위가 일반 대중에게 널리 알려지게 된 계기는 2018년 9월 7일자 한겨레신문의 단독보도였던 '세계적 과학자’ 김진수, 수천억대 특허 빼돌렸다' 기사 때문이다.
한겨레 기사의 골자는 기초과학연구원(IBS) 유전체교정연구단장인 김진수 교수가 서울대 교수로 재직시절(한국연구재단의 ‘창의연구지원사업’ 일환으로 연구비를 받던 시기) 국가 연구개발비를 지원받아 수천억 가치가 있는 세계적인 특허인 ‘크리스퍼 유전자가위’를 개발해놓고도 본인이 최대주주로 있는 툴젠이 개발한 것으로 날치기 했으며, 서울대는 이를 알고도 묵인ㆍ방조했다는 것이다.
국가로부터 연구비를 지원받았기 때문에 직무발명이며 발명자는 김진수 교수 혹은 산학에 참여했던 툴젠이 될 수 있으나 출원인은 사용자인 서울대학교(서울대산학협력단)가 되어야 한다. 서울대가 특허에 대한 통상실시권을 가질 뿐만 아니라 특허 등을 받을 수 있는 권리 또는 특허권 등을 승계 취득해야 한다. 그런데 서울대는 이를 헐값(1852만5천원)에 김진수 교수가 대주주로 있는 툴젠에 넘겼으며 수익금 1852만5천원 중 1564만9920원은 발명자 보상금으로 김진수 교수에게 도로 넘어갔다는 것이다.
이에 대해 서울대와 김진수 교수는 적법한 절차에 따라 특허권의 양도/양수가 이루어졌다고 주장했다. 지금까지 드러난 사실과 내부 감사 보고서 등을 종합하면 형법상 배임죄에 해당할 정도로 연구비 사용 관련 내부규정과 직무발명에 관한 기본 규정, 그리고 특허관리 규정을 모두 무시한 것으로 보여진다. 단 해당 기술이 수천억원 가치가 있다고 말하기는 힘들다. 사실 크리스퍼 유전자 가위 기술이 초기단계이고 앞으로 상용화를 위해서는 천문학적인 추가 비용이 들어갈 수 있어 한겨레 주장처럼 해당 특허가 당장 수천억짜리 기술 가치라고 단언하기에는 이르다.
최초로 크리스퍼 유전자 가위의 서막을 알린 제니퍼 다우드나 교수와 엠마뉴엘 카펜디어 교수의 특허 출원 내용(위 사진)을 보면 발명자는 제니퍼 다우드나 교수와 엠마뉴엘 카펜디어 교수및 주요 참여 연구자들이지만 특허권 양수자(Assignee)엔 늘 소속 학교가 항상 포함됨을 알 수 있다. 연구 개발이 기업이나 학교의 지원 아래 이루어진 직무발명이라면, 미국 기업 및 대학 연구자들이 발명을 했더라도 특허 소유권은 당연히 소속 기업(사용자)이나 학교가 가져간다.
결국 제니퍼 다우드나 교수와 엠마뉴엘 카펜디어 교수가 크리스퍼 쎄라퓨틱스 같은 회사의 창업자나 대주주로 활동하더라도 해당 기업은 특허 사용료를 특허권 양수자로 지정된 소속 학교에 지불하도록 되어 있다. 자본의 선순환이 해당 학계와 산업계를 동반 성장시킬 수 있도록 작용하는 기본 체계가 견고하게 갖추어져 있는 것이다. 발명자와 특허권 양수자는 별도의 계약을 통해 직무발명에 대한 보상을 발명자에게 충분히 해주고 있으며 발명자는 해당 특허기술을 사용하는 기업의 기술자문과 추가 공동 연구를 통하여 금전적인 보상과 연구비 펀딩을 받을 수 있다. 당연히 대기업이 대학의 특허권을 무단으로 사용하거나 탈취하는 경우에 해당 기업은 징벌적인 손해배상을 감수하여야 한다.

반면 김진수 교수의 미국 특허출원(가출원)은 2012년 10월 23일이며, 한국을 포함하는 PCT 국제출원은 1년 뒤인 2013년 10월 23일이다. 출원인은 주식회사 툴젠 그리고 국내특허 인명정보를 통해 확인한 최종 권리자 역시 김진수 교수가 대주주로 있는 주식회사 툴젠으로 되어 있다.

미국에 최초 출원한 김진수 교수의 특허 가출원 내용에도 특허권 양수자가 처음부터 주식회사 툴젠으로 되어 있다. 이 시기는 김진수 교수가 서울대 재직하면서 한국연구재단의 ‘창의연구지원사업’ 일환으로 연구비를 받아 관련 연구를 하던 시기로 약 2개월 후인 2013년 1월에는 네이처 바이오테크놀로지에 관련 논문도 발표 하게 된다. 이 논문의 마지막에는 한겨레 기사가 지적한 것처럼 “한국연구재단의 지원하에 이루어졌다”라는 영문 표기가 되어 있는 것도 사실이다.
결국 김진수 교수의 서울대 재직기간 특허는 직무발명의 결과로서 서울대산학협력단을 특허권자로 우선 지정하거나 신고했어야 했다. 이런 프로세스는 지켜지지 않았고 관련 출원과정에 대한 내부감사 역시 당시에는 투명하게 진행되지 않은 것으로 판단된다.
툴젠의 한겨레 기사에 대한 반박 내용 서두에는 다음과 같이 쓰여져 있다.
하지만 당시 미국 특허제도는 펭 장 교수팀 특허가 최종 등록된 판례처럼 선발명주의 채택 시기라서 출원일이 다소 늦더라도 제대로 된 최초의 연구발명임을 증명받으면 특허 등록이 가능한 때였다. 동일한 가출원 방식으로 출원한 제니퍼 다우드나 교수팀의 출원 명세서에는 출원 초기부터 소속 기관이 특허권자로 공동 등재되어 있다. 김 교수의 궁색한 변명으로 보인다.
미국 특허출원시 특허권 양수자(Assginee)는 발명인으로부터 한명도 빠짐없이 동의서명한 양도서류(Assignment)를 미국특허청내 양도국(Assignment Division)에 별도 제출하여 한다. 소속기관이 있으면 당연히 소속기관이 권리 양수자가 되는데 출원시점에 소속기관인 서울대에 발명신고를 하지 않고 당해년도 11월 진행한 것으로 보아서는 사전에 서울대와 특허권 양도/양수 협의 없이 본인이 대주주로 있는 툴젠으로 권리를 넘기기 위하여 등록한 것으로 밖에 볼 수 없다.
그리고 툴젠으로의 이전 비용(1852만5천원)역시 서울대학교 지식재산권 보호지침을 기준으로 보면 터무니 없이 싼 것은 사실이다. 보통 이런 경우 적어도 투입된 정부 지원금을 하한 선으로 이전 비용 산정이 이루어져야 하는 것이 당연하다. 해당 보호지침 역시 2012년 7월에 처음 제정된 것으로 보아 시행 초기에는 제대로 지켜지지 않은 것으로 판단된다. 현재 김진수 교수는 한 해 70억원이 넘는 연구비를 지원받는 기초과학연구원(IBS) 유전체교정연구단장직을 수행하고 있다. 해당 기관의 2018년 상반기 내부감사 보고서에서도 김진수 교수의 연구비 부당집행 관련 징계를 요청했던 것으로 알려져 더욱 의심을 할 수 밖에 없는 상황이다.
7. 연구 결과만큼 연구과정 윤리도 중요
부실한 기초과학 인프라속에서 산업화나 부가가치 창출이 단기간에 불확실하다고 연구원의 해외 특허 출원 비용 지원을 거부하는 대학, 장기적인 계획 없는 과학정책 입안자들, 단기 매출에만 급급한 기업들. 한국에서 흔히 볼 수 있는 모습이다. 이런 환경에서 김진수 교수 같은 석학이 나온 것은 진흙속의 진주나 마찬가지다. 웬만한 허물은 감싸주고 국가경제발전에 이바지할 수 있도록 의지를 북돋아 주어야 한다는 의견도 있다. 척박한 환경에서 김진수 교수 혼자 연구도 하고 특허도 내고 후학도 가르치려면 돈이 많이 필요한데 지원도 선진국에 비하여 충분하지 않으니 스스로 돈을 벌면서 하는 것 아니겠나는 의견도 있다. 연구 논문을 조작한 황우석과는 질적으로 다른, 세계가 인정한 논문을 발표한 석학이라고 칭하는 분들도 많다.
그러나 연구자에게는 연구 윤리를 기반으로 하는 사회적 책임 역시 연구 결과에 준하는 중요성을 가진다. 연구 결과만큼 연구 과정상 문제도 중요하다. 현대에 와서 연구 개발이 활발해지고, 과학기술이 사회에 막강한 영향력을 미치게 되면서 연구자의 사회적 책임이 강조될 수밖에 없다. 연구자의 사회적 책임이란 연구를 수행함에 있어 그 과정과 결과가 가지는 장기적이고 사회적인 영향력에 대해 도덕적 책임을 지는 것을 말한다. 연구자의 연구 과정이나 결과가 사회에 미치는 영향이 지대하기 때문이다.
미국의 연구윤리학자 레스닉(D. B. Resnik)은 많은 영향력 있는 연구기관에서 추구하는 윤리적 지향점을 조사하여 도출한 윤리원칙(ethical principles)을 정리했다. 이 중 공공자금을 이용한 연구시 요구되는 윤리는 아래와 같다.

김진수 교수는 연구결과에 있어서는 세계적인 수준일지 몰라도 사회적 책임을 가져야 하는 연구원의 연구윤리 관점으로 보면 이에 미치지 못한다. 관리ㆍ감독해야 할 서울대 역시 그 책임에서 자유롭지 못하다. 연구 분야의 특성상 김진수 교수의 특허기술이 정말 한겨레 기사처럼 수천억 가치를 지니고 있는지, 그리고 언제 수천억의 가치가 될지는 누구도 모른다. 아직 유전자 가위 기술은 태동기며 인간 유전체 30억개 염기서열의 극히 일부분에 대한 지식만 가지고 있다. 결국 상용화를 통해 막대한 부를 창출하기 까지 천문학적인 추가 국가 비용이 들어 갈 수 있다.
그래서 더욱 연구윤리가 중요한 것이다. 사소한 일이라고 주장하며 연구비 윤리문제를 눈감아주면 내일의 큰 연구범죄자를 키우는 꼴이 된다. 스타 과학자가 위대한 과학자가 될 수 있도록 연구윤리 기반 관리체계가 합리적으로 작동하는 것 역시 중요하다.